
如何检测蜂蜜中果糖、葡萄糖等四种糖的含量?
点击: 次 时间:2016-09-21 10:52
1 目的
测定蜂蜜中的果糖、葡萄糖、蔗糖和麦芽糖的含量。
2 实验部分
按照GB/T 22221-2008标准的方法进行样品前处理和仪器分析。
2.1仪器及试剂
高效液相色谱仪、2414示差折光检测器;果糖、葡萄糖、蔗糖和麦芽糖均为分析纯;乙腈,色谱纯;实验用水为Millpore超纯水系统制得,18MΩ•cm,25 ℃
2.2仪器分析条件
—参照GB/T 22221-2008标准方法设定
色谱柱:CNW Athena NH2(250mm×4.6mm, 5μm);流动相:乙腈:水=85:15;流速:1.0mL/min;进样体积:20μL;色谱柱温度:40℃;检测器温度:40℃
2.3 标准溶液的配制
分别准确称取一定质量的果糖、葡萄糖、蔗糖和麦芽糖用水溶解并定容至100mL,配成浓度为5g/100mL的标准储备溶液。
由于是条件摸索阶段,因此不急于配制系列标准溶液,先配制一个较高浓度的混合标准溶液(1g/100mL)用于确定仪器分析条件和标准曲线范围。
3 遇到的问题与分析
3.1 仪器分析条件的优化及单标确认
按照上述仪器分析方法对浓度为1g/100mL的混合标准溶液进行测定,测定结果见图1。

图1 糖混合标准溶液色谱图(乙腈:水=85:15)
从图中可以看出,虽然4种糖的混合标准溶液色谱图中对应出现4个色谱峰,但是却存在以下几个问题:
(1)该色谱条件下4种组分的分离时间较长,4种组分完全分离需要近35min,各组分之间的分离度较大,可以尝试进行条件优化,缩短检测时间;
(2)相同浓度下4种组分的出峰响应值相差较大,配制混合标准溶液时可以依据样品中的含量适当降低组分1或者增加其它组分的浓度;
(3)基线噪音较大,不利于微量组分的分析,对样品的定性和定量都会产生影响。
针对上述问题,决定先尝试优化仪器分析条件,缩短样品测试时间。
混合标准溶液的浓度在色谱柱和仪器的耐受范围内,由于是条件摸索阶段,因此暂时先不调整,仍然采用该浓度的混合标准溶液进行分析。
分析条件中采用的是示差检测器,该检测器不允许进行梯度洗脱,要改善分离条件缩短测试时间只能从流动相上做文章,于是尝试通过改变流动相比例进行优化。氨基色谱柱既可以用于正相模式反相模式,又可以用于反相模式,在正相模式下,可以代替硅胶柱使用;在反相模式下可用于碳水化合物的分析,尤其适用于糖类分析,本实验即是采用氨基色谱柱的反相模式进行糖类分析。
实验中发现微调流动相中有机相的含量,各组分间的分离度有很大的变化。增加乙腈的比例能够提高各组分间的分离度,但测试时间延长;降低乙腈的比例会降低各组分的分离度,但却很大程度上缩短了测试时间。当流动相为乙腈:水=75:25时,4种糖的测定时间缩短至15 min,同时4种糖具有较好的分离度。
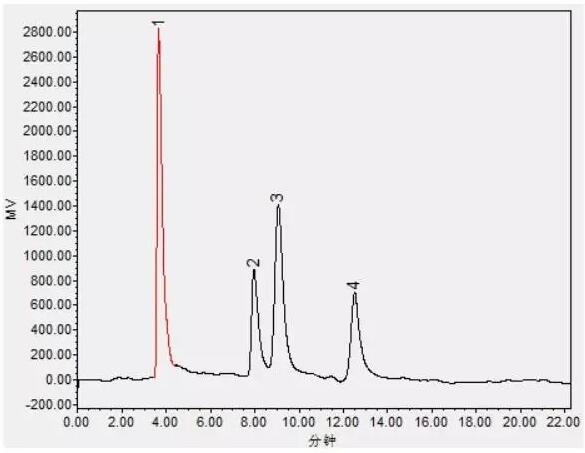
图2 糖混合标准溶液色谱图(乙腈:水=75:25)
上述测试过程中使用的是4种糖的混合标准溶液,每个峰对应的待测组分还是未知的,因此在该仪器分析条件下先对各组分进行单标确认。
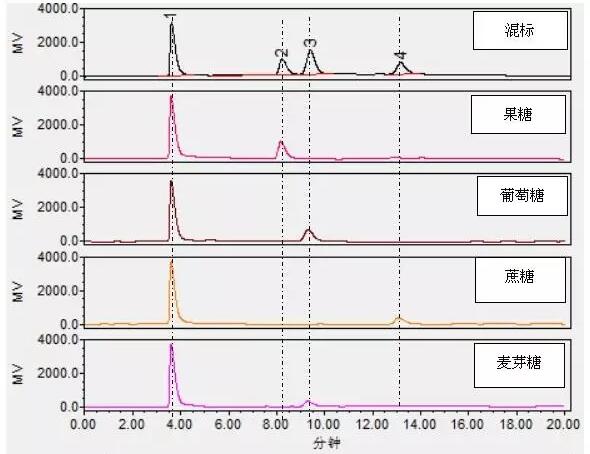
图3 单标确认色谱图
在单标确认的过程中又发现以下几个问题:
(1)虽然混合标准溶液色谱图中出现了4个完全分离的色谱峰,但是对比单标色谱图发现,每个单标色谱图中都出现了两个峰,而4min附近色谱峰的峰面积和峰高几乎一致,很有可能是溶剂峰;
(2)如果4min附近的色谱峰是溶剂峰,那么4种混合标准溶液色谱图中实际上只分离出了3种组分,有一种组分没有出峰或者与其他组分的保留时间接近;
(3)对比葡萄糖和麦芽糖的单标色谱图发现,两者的保留时间完全一致,可能是操作有误,两者组分在配制或在进样时弄错了。
针对上述问题逐一进行排查,由于所用的混合标准溶液是用水配制和稀释的,4min附近的色谱峰是否是溶剂峰只需进一针水样即可,因此首先以纯水为样品进行进样测试,并且重新配制葡萄糖和麦芽糖的标准溶液并测试,配制和进样过程及其仔细防止中间环节出错。
实验结果表明:4min附近的色谱峰为溶剂峰(见图4),同时重新测定后葡萄糖和麦芽糖的保留时间仍然完全一致。
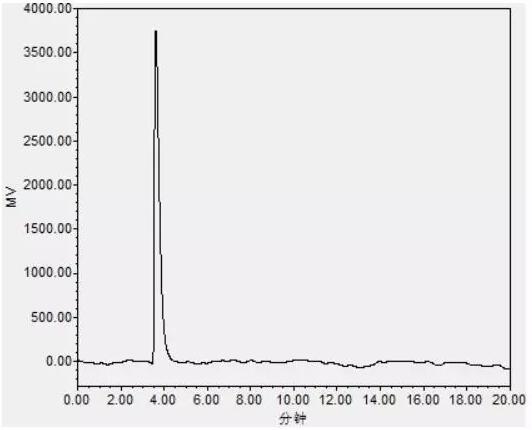
图4 水测试色谱图
葡萄糖和麦芽糖的保留时间一致,考虑是否是仪器分析方法不合适导致这两种组份没有分离?在前面的实验中发现,微调流动相比例4种糖的保留时间会有很明显的变化,于是尝试通过改变流动相的方式进行分离,然而实验中发现改变流动相两者的保留时间是同步变化的。
难道是色谱柱的原因?色谱柱柱效下降导致两者不能分离?于是更换新的色谱柱再次分离,结果还是没有能够将两者分离。如果葡萄糖和麦芽糖无法分离,实验便无法进行下去,在经过上述尝试之后将问题的矛头指向了所用的试剂。查试剂台账,发现实验室里还有其他品牌分析纯的葡萄糖,而麦芽糖仅此一瓶,但是幸运的是发现了葡萄糖和麦芽糖的标准品,决定使用麦芽糖和葡萄糖的标准品试一下。
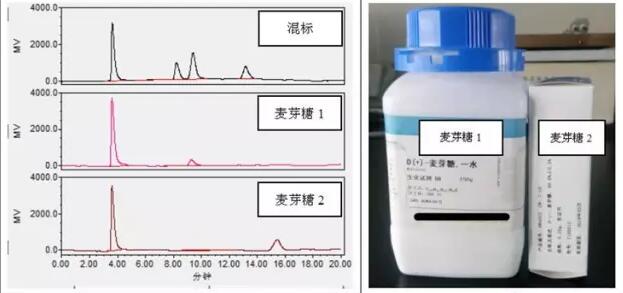
图5 不同麦芽糖标准品色谱图
实验结果表明:采用分析纯和标准品配制的葡萄糖标准溶液的出峰时间保持一致,而采用分析纯和标准品配制的麦芽糖标准溶液的出峰时间出现了差异。
重新配制4种糖的混合标准溶液,采用上述仪器分析条件进行测定时4种糖得到了较好的分离,因此继续延用上述的仪器分析条件进行后续测定。
3.2 溶剂效应的消除
4种糖的分离和确认过程基本完成,接下来解决溶剂效应的问题。溶剂效应在液相分析中是一种很常见有时也是很让人头疼的现象,严重的溶剂效应可能会影响到分析结果。溶剂效应产生的原因和处理方法论坛中早有前辈进行过细致的讲解,这里也不过多的赘述。
虽然此次的溶剂效应不会影响定性和定量,但是那“高高再上”的溶剂峰看着很难受,于是想尝试解决或者减轻溶剂效应,降低溶剂峰的峰响应。
为了减少分析时间,同时减少标准品的消耗(麦芽糖的标准品只有0.25g/瓶)决定直接用流动相中的两相(乙腈和水)进行尝试。通过改变乙腈和水的体积比考察溶剂峰的出峰情况。
实验发现,在上述色谱条件下以乙腈为样品进行测试时溶剂峰为响应值很大的倒峰;以水为样品进行测试时溶剂峰为响应值很大的正峰;调节两者的比例可以改变溶剂峰的出峰情况,如图6。
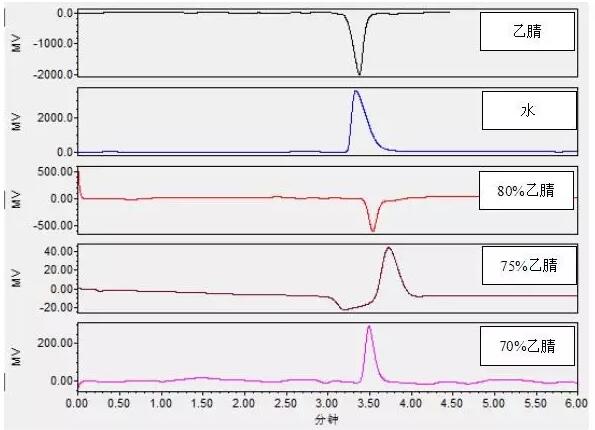
图6 乙腈水比例对溶剂峰的影响
从图中可以看出,试样为70%乙腈和80%乙腈时溶剂峰已经变小许多,而以流动相为样品(75%乙腈)时溶剂效应得到了进一步的降低,也就是人们常说的,可以尝试用流动相配制标准溶液或者定容样品减轻溶剂效应。
于是决定采用流动相配制标准溶液,然而在配制过程中又遇到了难题,高浓度糖的水溶液与乙腈不能互溶,两者会出现明显的分层。适当提高水相的比例,当采用50%乙腈水溶液时,两相没有出现分层,同时测定时有效地降低了溶剂效应,因此在后续的标准溶液配制和样品前处理过程中均采用50%乙腈水溶液。
3.3 基线噪音的消除
优化完仪器分析条件并解决了溶剂效应问题之后,接下来就要解决基线噪音的问题了。
液相中产生基线噪音的原因有:
(1) 灯能量下降;
(2)流通池污染;
(3)泵压不稳;
(4)气泡等。
依据消除基线噪音的方法分别对单向阀、色谱柱、样品池和参比池等进行维护,然后再对混合标准溶液进行测试,结果都没有能够得到理想的色谱图,基线噪音依旧很大。考虑到前期测定时流动相微调会对样品出峰有很大影响,同时依据示差检测器的检测原理(示差检测器是连续检测样品池和参比池间液体折光指数差值的检测器),该检测器对流动相的变化和温度都很敏感,而实验中流动相都是通过比例阀在线混合的方式进行的,在线混合不仅可能导致流动相组成会有微弱的差异,同时乙腈与水的在线混合也可能引起温度的变化,因此尝试采用流动相预先混合的方式,即按照在线混合优化后的比例进行预先配制流动相然后进行测试,采用该方法后基线噪音得到明显改善。
注:流动相在线混合的方式虽然会引起基线噪音,但是在前期方法摸索阶段,对流动相进行优化时还是方便可行的,可以通过此方法摸索出合适的流动相比例后再采用预混的方法进行测定。
(内容参考仪器信息网)
上一篇:高效液相色谱仪测定山楂中熊果酸含量的应用方案 下一篇:香精香料工厂污水中有哪些成分


